
|
|
ВНИМАНИЕ! Это раздел УЧЕБНИКОВ, раздел решебников в другом месте. 7 класс - 8 класс - 9 класс - 10 класс - 11 класс  Химия, 10 класс (Гузей Л.С., Суровцева Р.П.) 1999Страница № 192.Учебник: Химия. 10 класс. Учебник / Гузей Л.С., Суровцева Р.П.; 2-е изд.- М.: Дрофа, 1999. - 240с. Страницы учебника: 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49, 50, 51, 52, 53, 54, 55, 56, 57, 58, 59, 60, 61, 62, 63, 64, 65, 66, 67, 68, 69, 70, 71, 72, 73, 74, 75, 76, 77, 78, 79, 80, 81, 82, 83, 84, 85, 86, 87, 88, 89, 90, 91, 92, 93, 94, 95, 96, 97, 98, 99, 100, 101, 102, 103, 104, 105, 106, 107, 108, 109, 110, 111, 112, 113, 114, 115, 116, 117, 118, 119, 120, 121, 122, 123, 124, 125, 126, 127, 128, 129, 130, 131, 132, 133, 134, 135, 136, 137, 138, 139, 140, 141, 142, 143, 144, 145, 146, 147, 148, 149, 150, 151, 152, 153, 154, 155, 156, 157, 158, 159, 160, 161, 162, 163, 164, 165, 166, 167, 168, 169, 170, 171, 172, 173, 174, 175, 176, 177, 178, 179, 180, 181, 182, 183, 184, 185, 186, 187, 188, 189, 190, 191, «192», 193, 194, 195, 196, 197, 198, 199, 200, 201, 202, 203, 204, 205, 206, 207, 208, 209, 210, 211, 212, 213, 214, 215, 216, 217, 218, 219, 220, 221, 222, 223, 224, 225, 226, 227, 228, 229, 230, 231, 232, 233, 234, 235, 236, 237
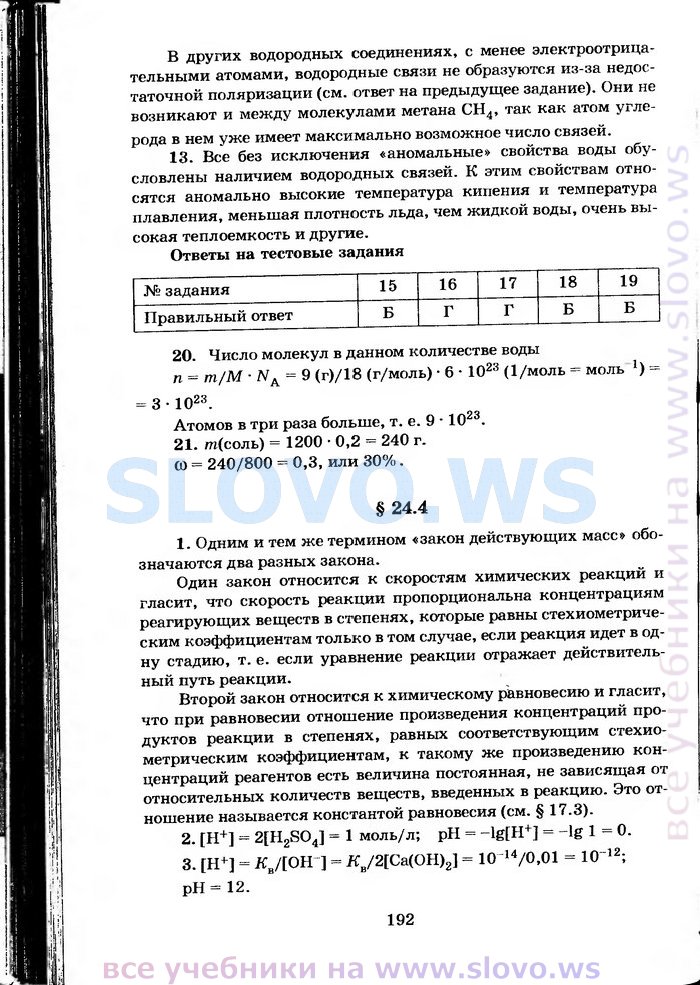 OCR-версия страницы из учебника (текст страницы, которая находится выше):в других водородных соединениях, с менее электроотрицательными атомами, водородные связи не образуются из-за недостаточной поляризации (см. ответ на предыдущее задание). Они не возникают и между молекулами метана СН4, так как атом углерода в нем уже имеет максимально возможное число связей. 13. Все без исключения «аномальные» свойства воды обусловлены наличием водородных связей. К этим свойствам относятся аномально высокие температура кипения и температура плавления, меньшая плотность льда, чем жидкой воды, очень вы сокая теплоемкость и другие. Ответы на тестовые задания
20. Число молекул в данном количестве воды п = т/М ■ Na = 9 (г)/18 (г/моль) • 6 • 1023 (1/моль = моль *) = Атомов в три раза больше, т. е. 9 • 1023. 21. т(соль) = 1200 ■ 0,2 = 240 г. СО = 240/800 = 0,3, или 30%. § 24.4 1. Одним и тем же термином «закон действующих масс» обозначаются два разных закона. Один закон относится к скоростям химических реакции и гласит, что скорость реакции пропорциональна концентрациям реагирующих веществ в степенях, которые равны стехиометриче-ским коэффициентам только в том случае, если реакция идет в одну стадию, т. е. если уравнение реакции отражает действительный путь реакции. Второй закон относится к химическому равновесию и гласит, что при равновесии отношение произведения концентраций продуктов реакции в степенях, равных соответствующим стехио-метрическим коэффициентам, к такому же произведению концентраций реагентов есть величина постоянная, не зависящая от относительных количеств веществ, введенных в реакцию. Это отношение называется константой равновесия (см. § 17.3). 2. [Н+] = 2[H2S04] = 1 моль/л; pH = -lg[H+] = -lg 1 = 0. 3. [Н+] = Яв/[ОН-] = Яв/2[Са(ОН)2] = 10 14/0,01 = Ю12; рН= 12. Страницы учебника: 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49, 50, 51, 52, 53, 54, 55, 56, 57, 58, 59, 60, 61, 62, 63, 64, 65, 66, 67, 68, 69, 70, 71, 72, 73, 74, 75, 76, 77, 78, 79, 80, 81, 82, 83, 84, 85, 86, 87, 88, 89, 90, 91, 92, 93, 94, 95, 96, 97, 98, 99, 100, 101, 102, 103, 104, 105, 106, 107, 108, 109, 110, 111, 112, 113, 114, 115, 116, 117, 118, 119, 120, 121, 122, 123, 124, 125, 126, 127, 128, 129, 130, 131, 132, 133, 134, 135, 136, 137, 138, 139, 140, 141, 142, 143, 144, 145, 146, 147, 148, 149, 150, 151, 152, 153, 154, 155, 156, 157, 158, 159, 160, 161, 162, 163, 164, 165, 166, 167, 168, 169, 170, 171, 172, 173, 174, 175, 176, 177, 178, 179, 180, 181, 182, 183, 184, 185, 186, 187, 188, 189, 190, 191, «192», 193, 194, 195, 196, 197, 198, 199, 200, 201, 202, 203, 204, 205, 206, 207, 208, 209, 210, 211, 212, 213, 214, 215, 216, 217, 218, 219, 220, 221, 222, 223, 224, 225, 226, 227, 228, 229, 230, 231, 232, 233, 234, 235, 236, 237
Учебник: Химия. 10 класс. Учебник / Гузей Л.С., Суровцева Р.П.; 2-е изд.- М.: Дрофа, 1999. - 240с. Все учебники по химии:
Учебники по химии за 7 классУчебники по химии за 8 классУчебники по химии за 9 классУчебники по химии за 10 классУчебники по химии за 11 класс |
|
© 2022 ќксперты сайта vsesdali.com проводЯт работы по составлению материала по предложенной заказчиком теме. ђезультат проделанной работы служит источником для написания ваших итоговых работ.