
|
|
ВНИМАНИЕ! Это раздел УЧЕБНИКОВ, раздел решебников в другом месте. 7 класс - 8 класс - 9 класс - 10 класс - 11 класс  Органическая химия, 10 класс (Рудзитис Г. Е., Фельдман Ф. Г.) 2000Страница № 147.Учебник: Химия: Орган, химия: Учеб. для 10 кл. общеобразоват. учреждений / Рудзитис Г. Е., Фельдман Ф. Г. — 7-е изд. — М.: Просвещение, 2000. — 160 с.: ил. Страницы учебника: 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49, 50, 51, 52, 53, 54, 55, 56, 57, 58, 59, 60, 61, 62, 63, 64, 65, 66, 67, 68, 69, 70, 71, 72, 73, 74, 75, 76, 77, 78, 79, 80, 81, 82, 83, 84, 85, 86, 87, 88, 89, 90, 91, 92, 93, 94, 95, 96, 97, 98, 99, 100, 101, 102, 103, 104, 105, 106, 107, 108, 109, 110, 111, 112, 113, 114, 115, 116, 117, 118, 119, 120, 121, 122, 123, 124, 125, 126, 127, 128, 129, 130, 131, 132, 133, 134, 135, 136, 137, 138, 139, 140, 141, 142, 143, 144, 145, 146, «147», 148, 149, 150, 151, 152, 153, 154, 155, 156, 157, 158, 159, 160
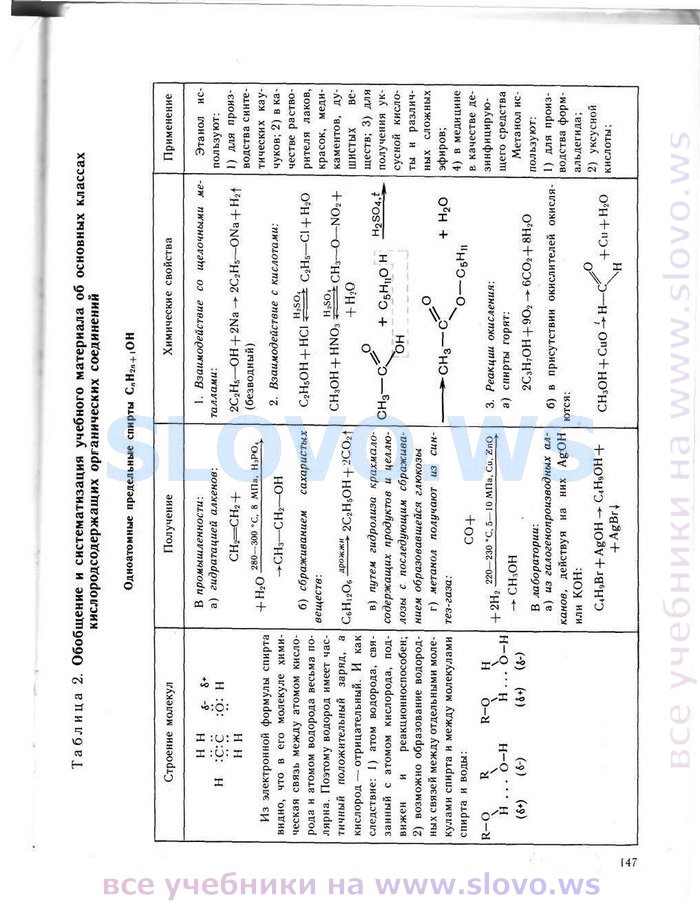 OCR-версия страницы из учебника (текст страницы, которая находится выше):Одноатомные предельные спирты С„Н2п+|ОН Строение молекул Получение Химические свойства Применение Н Н н :С'С н и 4- 8* :5: Н Из электронной формулы спирта видно, что в его молекуле химическая связь между атомом кислорода и атомом водорода весьма по-лярна. Поэтому водород имеет частичный положительный заряд, а кислород — отрицательный. И как следствие: 1) атом водорода, связанный с атомом кислорода, подвижен и реакционноспособен; 2) возможно образование водородных связей между отдельными молекулами спирта и между молекулами спирта и воды: R—О R R—О Н \ \ \ \ Н ... О-Н Н ... О-Н <«♦) <«-) (&+) («-) В промышленности-. а) гидратацией алкенов: + Н20 СНг=СН2 + 280—300 «С. 8 МПа. НаРО. -►СНз—СНг—ОН б) сбраживанием сахаристых веществ: с6н12о, дрожжи 2С2Н5ОН + 2СОИ в) путем гидролиза крахмалосодержащих продуктов и целлюлозы с последующим сбраживанием образовавшейся глюкозы г) метанол получают из син-тез-газа: + 2Н: СО + 220—230 “С, 5—10 МПа. Си. ZnO — сн,он В лаборатории: а) из галогенопроизводных алканов, действуя на них AgOH или КОН: C.HaBr + AgOH -» С4Н9ОН + -f AgBrj 1. Взаимодействие со щелочными металлами: 2С2Н5—OH+2Na — 2С2Н5—ONa + Hat (безводный) 2. Взаимодействие с кислотами: С2Н5ОН + НС1 СН3ОН + НЫОз H2SO, H,SO. 4- Н .О С2Н5—С! + Н20 СНз—О—N02 -(- О СН3— + с5н„о н он .о -►СНз—с + н2о ^о—с5н„ 3. Реакции окисления: а) спирты горят: 2С3Н7ОН + Э02 — 6С02 + 8Н20 б) в присутствии окислителей окисляются: .О СНзОН + СиО-^Н—С( + Си + Н20 \н Этанол ис-пол ьзуют: 1) для производства синте-тических кау-чуков; 2) в ка-честве растворителя лаков, красок, меди* каментов, душистых Вв-ществ; 3) для получения ук- СуСНОЙ КИСЛО' ты и различных сложных эфиров; 4) в медицине в качестве дезинфицирующего средства Метанол используют: 1) для производства формальдегида; 2) уксусной кислоты; Страницы учебника: 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49, 50, 51, 52, 53, 54, 55, 56, 57, 58, 59, 60, 61, 62, 63, 64, 65, 66, 67, 68, 69, 70, 71, 72, 73, 74, 75, 76, 77, 78, 79, 80, 81, 82, 83, 84, 85, 86, 87, 88, 89, 90, 91, 92, 93, 94, 95, 96, 97, 98, 99, 100, 101, 102, 103, 104, 105, 106, 107, 108, 109, 110, 111, 112, 113, 114, 115, 116, 117, 118, 119, 120, 121, 122, 123, 124, 125, 126, 127, 128, 129, 130, 131, 132, 133, 134, 135, 136, 137, 138, 139, 140, 141, 142, 143, 144, 145, 146, «147», 148, 149, 150, 151, 152, 153, 154, 155, 156, 157, 158, 159, 160
Учебник: Химия: Орган, химия: Учеб. для 10 кл. общеобразоват. учреждений / Рудзитис Г. Е., Фельдман Ф. Г. — 7-е изд. — М.: Просвещение, 2000. — 160 с.: ил. Все учебники по химии:
Учебники по химии за 7 классУчебники по химии за 8 классУчебники по химии за 9 классУчебники по химии за 10 классУчебники по химии за 11 класс |
|
© 2022 ќксперты сайта vsesdali.com проводЯт работы по составлению материала по предложенной заказчиком теме. ђезультат проделанной работы служит источником для написания ваших итоговых работ.